Es importante ir monitoreando el aprendizaje de todos. Es por esto que a continuación se presentan "las respuestas ideales" de las actividades de la última semana.
Lee y compara con tu respuesta, agrega la información que te falte si es necesario, y si tu respuesta no era la adecuada ¡Tranquilo!, no pasa nada, estás aprendiendo y ya tendremos tiempo de resolver todas las dudas.
Recuerda que lo más importante es que siempre escribas tu hipótesis y realices tus actividades, el error lo podremos corregir en el camino, los hábitos son para siempre y te ayudarán a completar todas las metas que te propongas.
Solucionario actividad de aplicación 09 de abril
Considerando las leyes explicadas con anterioridad y utilizando las formulas expuesta y los contenidos trabajados, resuelve los siguientes ejercicios en tu cuaderno:
-
Ejercicio Nº 1: A presión de 17 atm, 34 L de un gas a temperatura constante experimenta un cambio ocupando un volumen de 15 L ¿Cuál será la presión que ejerce?
Primero analicemos los datos:
Tenemos presión (P 1 ) = 17 atm
Tenemos volumen (V 1 ) = 34 L
Tenemos volumen (V 2 ) = 15 L
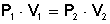 Reemplazamos con los valores conocidos
Reemplazamos con los valores conocidos
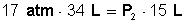 Colocamos a la izquierda de la ecuación el miembro que tiene la incógnita (P 2 ) y luego la despejamos:
Colocamos a la izquierda de la ecuación el miembro que tiene la incógnita (P 2 ) y luego la despejamos:
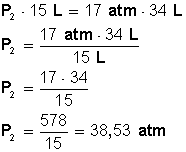 Respuesta:
Para que el volumen baje hasta los 15 L, la nueva presión será de 38,53 atmósferas.
Respuesta:
Para que el volumen baje hasta los 15 L, la nueva presión será de 38,53 atmósferas.
-
Ejercicio Nº 2: ¿Qué volumen ocupa un gas a 980 mmHg, si el recipiente tiene finalmente una presión de 1,8 atm y el gas se comprime a 860 cc?
Analicemos los datos que nos dan:
Tenemos presión (P 1 ) = 980 mmHg
Tenemos presión (P 2 ) = 1,8 atm
Tenemos volumen (V 2 ) = 860 cc
Lo primero que debemos hacer es uniformar las unidades de medida.
Recuerda que la presión debe estar o en atmósferas (atm) o en milímetros de Mercurio (mmHg), pero no en ambas, y que el volumen debe estar en litros (L).
P 1 = 980 mmHg (lo dejamos igual)
P 2 = 1,8 atm lo multiplicamos por 760 y nos da 1.368 mmHg. Esto porque 1 atmósfera es igual a 760 mmHg
V 2 = 860 centímetros cúbicos lo expresamos en litros dividiendo por mil, y nos queda V 2 = 0,86 L (recuerda que un litro es igual a mil centímetros cúbicos).
Como vemos, de nuevo estamos relacionando presión (P) con volumen (V), a temperatura constante, por ello aplicamos la ecuación que nos brinda la Ley de Boyle (presión y volumen son inversamente proporcionales):
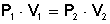 Reemplazamos con los valores conocidos
Reemplazamos con los valores conocidos
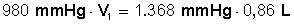 Ahora despejamos V 1
Ahora despejamos V 1
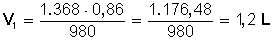 Respuesta:
A una presión de 980 mmHg dicho gas ocupa un volumen de 1,2 L (1.200 centímetros cúbicos).
Respuesta:
A una presión de 980 mmHg dicho gas ocupa un volumen de 1,2 L (1.200 centímetros cúbicos).
-
Ejercicio Nº 3: A volumen constante un gas ejerce una presión de 880 mmHg a 20º C ¿Qué temperatura habrá si la presión aumenta en 15 %?
Analicemos los datos:
Tenemos presión P 1 = 880 mmHg
Tenemos presión P 2 = 880 mmHg más el 15 % = 880 +132= 1.012 mmHg
Tenemos temperatura T 1 = 20º C
Lo primero que debemos hacer es uniformar las unidades de medida.
Recuerda que la temperatura (T) debe estar en grados Kelvin, y que la presión (P) puede estar solo en atm o solo en mmHg en una misma ecuación.
P 1 = 880 mmHg, lo dejamos igual
P 2 = 1.012 mmHg lo dejamos igual
T 1 = 20º C le sumamos 273 para dejarlos en 293º Kelvin (recuerda que 0º C es igual a 273º K) (Nota: En realidad son 273,15, pero para facilitar los cálculos prescindiremos de los decimales).
En este problema estamos relacionando presión (P) con temperatura (T) a volumen (V) constante, por lo tanto aplicamos la fórmula que nos brinda la Ley de Gay-Lussac (presión y temperatura son directamente proporcionales).
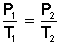 Reemplazamos con los valores conocidos
Reemplazamos con los valores conocidos
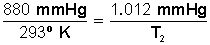 Desarrollamos la ecuación:
Primero multiplicamos en forma cruzada, dejando a la izquierda el miembro con la incógnita, para luego despejar P 2 :
Desarrollamos la ecuación:
Primero multiplicamos en forma cruzada, dejando a la izquierda el miembro con la incógnita, para luego despejar P 2 :
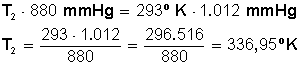 Respuesta:
Si aumentamos la presión en 15 % el gas quedará a una temperatura de 336,95º K, los cuales equivalen a 63,95º C. (336,95 − 273 = 63,95º C).
Respuesta:
Si aumentamos la presión en 15 % el gas quedará a una temperatura de 336,95º K, los cuales equivalen a 63,95º C. (336,95 − 273 = 63,95º C).
- Ejercicio Nº 4: Cuando un gas a 85º C y 760 mmHg, a volumen constante en un cilindro, se comprime, su temperatura disminuye dos tercios (2/3) ¿Qué presión ejercerá el gas?
Analicemos los datos:
Tenemos presión P 1 = 760 mmHg
Tenemos temperatura T 1 = 85º C
Tenemos temperatura T 2 = 85º C menos 2/3 = 85 − 56,66 = 28,34º C
Lo primero que debemos hacer es uniformar las unidades de medida.
Recuerda que la temperatura (T) debe estar en grados Kelvin, y que la presión (P) puede estar solo en atm o solo en mmHg en una misma ecuación.
P 1 = 760 mmHg, lo dejamos igual
T 1 = 85º C le sumamos 273 para quedar en 358º K (recuerda que 0º C es igual a 273º K) (Nota: En realidad son 273,15, pero para facilitar los cálculos prescindiremos de los decimales).
T 2 = 28,34º C le sumamos 273 para quedar en 301,34º K
En este problema estamos relacionando presión (P) con temperatura (T) a volumen (V) constante, por lo tanto aplicamos la fórmula que nos brinda la Ley de Gay-Lussac (presión y temperatura son directamente proporcionales).
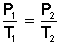 Reemplazamos con los valores conocidos
Reemplazamos con los valores conocidos
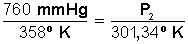 Desarrollamos la ecuación:
Primero multiplicamos en forma cruzada, dejando a la izquierda el miembro con la incógnita, para luego despejar P 2 :
Desarrollamos la ecuación:
Primero multiplicamos en forma cruzada, dejando a la izquierda el miembro con la incógnita, para luego despejar P 2 :
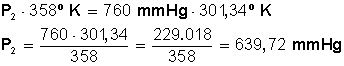 Respuesta
La presión baja hasta los 639,72 mmHg, equivalentes 0,84 atmósfera (1 atm = 760 mmHg).
Respuesta
La presión baja hasta los 639,72 mmHg, equivalentes 0,84 atmósfera (1 atm = 760 mmHg).
Ejercicio Nº 1: A presión de 17 atm, 34 L de un gas a temperatura constante experimenta un cambio ocupando un volumen de 15 L ¿Cuál será la presión que ejerce?
Primero analicemos los datos:
Tenemos presión (P 1 ) = 17 atm
Tenemos volumen (V 1 ) = 34 L
Tenemos volumen (V 2 ) = 15 L
Reemplazamos con los valores conocidos
Colocamos a la izquierda de la ecuación el miembro que tiene la incógnita (P 2 ) y luego la despejamos:
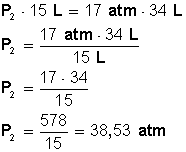
Respuesta:
Para que el volumen baje hasta los 15 L, la nueva presión será de 38,53 atmósferas.
Ejercicio Nº 2: ¿Qué volumen ocupa un gas a 980 mmHg, si el recipiente tiene finalmente una presión de 1,8 atm y el gas se comprime a 860 cc?
Analicemos los datos que nos dan:
Tenemos presión (P 1 ) = 980 mmHg
Tenemos presión (P 2 ) = 1,8 atm
Tenemos volumen (V 2 ) = 860 cc
Lo primero que debemos hacer es uniformar las unidades de medida.
Recuerda que la presión debe estar o en atmósferas (atm) o en milímetros de Mercurio (mmHg), pero no en ambas, y que el volumen debe estar en litros (L).
P 1 = 980 mmHg (lo dejamos igual)
P 2 = 1,8 atm lo multiplicamos por 760 y nos da 1.368 mmHg. Esto porque 1 atmósfera es igual a 760 mmHg
V 2 = 860 centímetros cúbicos lo expresamos en litros dividiendo por mil, y nos queda V 2 = 0,86 L (recuerda que un litro es igual a mil centímetros cúbicos).
Como vemos, de nuevo estamos relacionando presión (P) con volumen (V), a temperatura constante, por ello aplicamos la ecuación que nos brinda la Ley de Boyle (presión y volumen son inversamente proporcionales):
Reemplazamos con los valores conocidos
Ahora despejamos V 1
Respuesta:
A una presión de 980 mmHg dicho gas ocupa un volumen de 1,2 L (1.200 centímetros cúbicos).
Ejercicio Nº 3: A volumen constante un gas ejerce una presión de 880 mmHg a 20º C ¿Qué temperatura habrá si la presión aumenta en 15 %?
Analicemos los datos:
Tenemos presión P 1 = 880 mmHg
Tenemos presión P 2 = 880 mmHg más el 15 % = 880 +132= 1.012 mmHg
Tenemos temperatura T 1 = 20º C
Lo primero que debemos hacer es uniformar las unidades de medida.
Recuerda que la temperatura (T) debe estar en grados Kelvin, y que la presión (P) puede estar solo en atm o solo en mmHg en una misma ecuación.
P 1 = 880 mmHg, lo dejamos igual
P 2 = 1.012 mmHg lo dejamos igual
T 1 = 20º C le sumamos 273 para dejarlos en 293º Kelvin (recuerda que 0º C es igual a 273º K) (Nota: En realidad son 273,15, pero para facilitar los cálculos prescindiremos de los decimales).
En este problema estamos relacionando presión (P) con temperatura (T) a volumen (V) constante, por lo tanto aplicamos la fórmula que nos brinda la Ley de Gay-Lussac (presión y temperatura son directamente proporcionales).
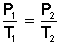
Reemplazamos con los valores conocidos
Desarrollamos la ecuación:
Primero multiplicamos en forma cruzada, dejando a la izquierda el miembro con la incógnita, para luego despejar P 2 :
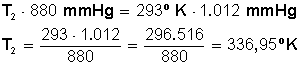
Respuesta:
Si aumentamos la presión en 15 % el gas quedará a una temperatura de 336,95º K, los cuales equivalen a 63,95º C. (336,95 − 273 = 63,95º C).
Analicemos los datos:
Tenemos presión P 1 = 760 mmHg
Tenemos temperatura T 1 = 85º C
Tenemos temperatura T 2 = 85º C menos 2/3 = 85 − 56,66 = 28,34º C
Lo primero que debemos hacer es uniformar las unidades de medida.
Recuerda que la temperatura (T) debe estar en grados Kelvin, y que la presión (P) puede estar solo en atm o solo en mmHg en una misma ecuación.
P 1 = 760 mmHg, lo dejamos igual
T 1 = 85º C le sumamos 273 para quedar en 358º K (recuerda que 0º C es igual a 273º K) (Nota: En realidad son 273,15, pero para facilitar los cálculos prescindiremos de los decimales).
T 2 = 28,34º C le sumamos 273 para quedar en 301,34º K
En este problema estamos relacionando presión (P) con temperatura (T) a volumen (V) constante, por lo tanto aplicamos la fórmula que nos brinda la Ley de Gay-Lussac (presión y temperatura son directamente proporcionales).
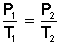
Reemplazamos con los valores conocidos
Desarrollamos la ecuación:
Primero multiplicamos en forma cruzada, dejando a la izquierda el miembro con la incógnita, para luego despejar P 2 :
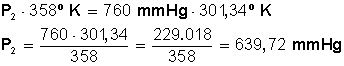
Respuesta
La presión baja hasta los 639,72 mmHg, equivalentes 0,84 atmósfera (1 atm = 760 mmHg).



No hay comentarios:
Publicar un comentario